Dieses Wiki, das alte(!) Projektwiki (projektwiki.zum.de)
wird demnächst gelöscht.
Bitte sichere Deine Inhalte zeitnah,
wenn Du sie weiter verwenden möchtest.
Gerne kannst Du natürlich weiterarbeiten
im neuen Projektwiki (projekte.zum.de).Extraktion: Unterschied zwischen den Versionen
Belofb (Diskussion | Beiträge) |
Belofb (Diskussion | Beiträge) (→Verwendung) |
||
| (17 dazwischenliegende Versionen von 4 Benutzern werden nicht angezeigt) | |||
| Zeile 1: | Zeile 1: | ||
== Industrieller Extraktionsprozess == | == Industrieller Extraktionsprozess == | ||
| − | [[Datei:Grundfließbild Industrielle Extraktion.jpg|Grundfließbild Industrielle Extraktion| | + | [[Datei:Grundfließbild Industrielle Extraktion.jpg|thumb|Grundfließbild Industrielle Extraktion|600px]] |
=== Definition === | === Definition === | ||
| Zeile 18: | Zeile 18: | ||
Das Lösemittel löst den Extraktstoff, sodass eine Extraktstofflösung entsteht. Die Extraktstoffklösung besteht aus dem Lösemittel und dem gelösten Extraktstoff. | Das Lösemittel löst den Extraktstoff, sodass eine Extraktstofflösung entsteht. Die Extraktstoffklösung besteht aus dem Lösemittel und dem gelösten Extraktstoff. | ||
Die Extraktstofflösung wird nach dem Extraktionsprozess zum nächsten Prozessschritt, der Eindampfung, transportiert. | Die Extraktstofflösung wird nach dem Extraktionsprozess zum nächsten Prozessschritt, der Eindampfung, transportiert. | ||
| + | Beispiele für Extraktionsprozesse: | ||
| + | * Kaffee kochen | ||
| + | * Tee kochen | ||
| + | * Kristallzuckerherstellung | ||
| + | * Bierherstellung | ||
| + | * Gemüsebrühe | ||
=== 2. Zentrifugierprozess (Nebenprozess) === | === 2. Zentrifugierprozess (Nebenprozess) === | ||
| Zeile 42: | Zeile 48: | ||
=== 5. Lösemittelkreislauf === | === 5. Lösemittelkreislauf === | ||
| − | Die Brüden, die aus dem Eindampfungsprozess (als Wasserdampf) und aus dem Trocknungsprozess (als feuchte Luft) hervorgehen, werden aufgefangen und zu einem Kondensator geleitet. In dem Kondensationsprozess gehen die Brüden von ihren gasförmigen Zustand wieder in einen flüssigen Zustand über. Das flüssige zurückgewonnene Lösemittel | + | Die Brüden, die aus dem Eindampfungsprozess (als Wasserdampf) und aus dem Trocknungsprozess (als feuchte Luft) hervorgehen, werden aufgefangen und zu einem Kondensator geleitet. In dem Kondensationsprozess gehen die Brüden von ihren gasförmigen Zustand wieder in einen flüssigen Zustand über. Das flüssige zurückgewonnene Lösemittel kann dem |
| − | Extraktionsprozess wieder zugeführt. | + | Extraktionsprozess wieder zugeführt werden. |
| + | |||
| + | == Extraktionsprozess Labor == | ||
| + | === Pfeffer/ Piperin === | ||
| + | |||
| + | [https://commons.wikimedia.org/wiki/File:Soxhlet_mechanism.gif#/media/File:Soxhlet_mechanism.gif Extraktion Soxhlet- Rückflusskühler] | ||
| + | |||
| + | <iframe src="https://player.vimeo.com/video/159944215" width="640" height="360" frameborder="0" allow="autoplay; fullscreen; picture-in-picture" allowfullscreen></iframe> | ||
| + | <br /> | ||
| + | |||
| + | |||
| + | Piperin ist das am häufigsten vorkommende Alkaloid im Pfeffer und ist wahrscheinlich für die Schärfe des Pfeffers verantwortlich. Je nach Pfeffersorten beträgt der Anteil an Piperin 5-9%. Dieses Alkaloid ist ein gelblicher Feststoff, der eine Kristallstruktur besitzt, sehr lichtempfindlich ist und 1819 von Hans Christian Örsted erstmals isoliert wurde. Es ist im Fruchtfleisch und in der Zellwand enthalten. | ||
| + | |||
| + | Die Isolation von Piperin erfolgt mit Hilfe einer Soxhlet- Extraktionsapparat. Bei diesem Verfahren wird in einen Rundkolben ein Lösungsmittel (Diclormethan) gegeben, welche Piperin gut löst und in der Lage ist diesen aus Pfeffer zu extrahieren. Auf den Rundkolben wird ein Soxhlet- Aufsatz aufgesetzt, in dessen Extraktionsraum sich eine Extraktionshülse mit gemahlenem Pfeffer befindet. Auf den Soxhlet- Aufsatz wird anschließend ein Rückflusskühler gesetzt und das Lösungsmittel im Rundkolben bis zum Sieden erhitzt. Das Lösungsmittel verdampft, steigt über das Dampfleitungsrohr auf, kondensiert im Rückflusskühler und läuft in den Extraktionsraum, wobei es das im Pfeffer enthaltene Piperin herauslöst. Durch weiteres Zutropfen des Lösungsmittels, steigt der Flüssigkeitspegel bis zur Höhe des Heberohrs an. Wenn diese Höhe erreicht ist, wird das Lösungsmittel durch die auftretende Saughebewirkung in den Kolben zurück befördert. Dieser Prozess findet solange statt, bis das gesamte im Pfeffer enthaltene Piperin isoliert wurde. Dabei wird das im Rundkolben enthaltene Lösungsmittel bzw. Extrakt mit Hilfe eines Rotationsverdampfers konzentriert. Zurück bleib ein gelblicher Feststoff, das Piperin. | ||
| + | == Extraktion mit überkritischem CO2 == | ||
| + | Überkritisches Kohlenstoffdioxid (auch superkritisches Kohlenstoffdioxid oder scCO2, von englisch "supercritical") ist Kohlenstoffdioxid in einem fluiden Zustand über seiner kritischen Temperatur und seinem kritischen Druck. | ||
| + | ===Eigenschaften=== | ||
| + | Im überkritischen Aggregatzustand hat Kohlenstoffdioxid deutlich andere Eigenschaften als unter Normbedingungen, die zwischen den Eigenschaften von Gas und Flüssigkeit liegen. So ist es genauso dicht wie eine Flüssigkeit, hat aber dieselbe Viskosität wie ein Gas.[1] | ||
| + | [[File:Carbon dioxide pressure-temperature phase diagram deutsch.png|Carbon dioxide pressure-temperature phase diagram deutsch]] | ||
| + | |||
| + | Überkritisches Kohlenstoffdioxid (auch superkritisches Kohlenstoffdioxid oder scCO2, von englisch "supercritical") ist Kohlenstoffdioxid in einem fluiden Zustand über seiner kritischen Temperatur und seinem kritischen Druck. | ||
| + | Eigenschaften | ||
| + | |||
| + | ===Verwendung=== | ||
| + | Durch die leichte Verfügbarkeit, die Ungiftigkeit und die leichte Abtrennung von den gelösten Stoffen ist überkritisches Kohlenstoffdioxid ein vielversprechendes Lösungsmittel für vielfältige Anwendungen. | ||
| + | Überkritisches Kohlenstoffdioxid ist dank seiner Fließfähigkeit eine überaus agile Substanz. Dadurch kann es in andere Stoffe eindringen und wird in der Industrie als Extraktionsmittel oder Destraktionsmittel (z. B. zur Entkoffeinierung von Kaffee) genutzt. Im Jahr 2007 wurden bereits ein Fünftel aller entkoffeinierten Kaffees durch Extraktion mit überkritischem Kohlenstoffdioxid hergestellt. Es wird aber auch für eine Vielzahl anderer industrieller Prozesse als Aufschäummittel, Kühlmittel und Lösungsmittel genutzt. | ||
| + | |||
| + | Die folgende Tabelle gibt einen Überblick über die Löslichkeit verschiedener chemischer Stoffklassen in fluidem CO2 | ||
| + | |||
| + | |||
| + | {| class="wikitable" | ||
| + | ! Löslichkeit | ||
| + | ! Substanzklassen | ||
| + | ! Lebensmittelinhaltsstoffe | ||
| + | |- | ||
| + | |gut | ||
| + | |lipophile unpolare Komponenten, mittelpolare Komponenten von niedrigem und mittlerem Molekulargewicht | ||
| + | |Aromen, Terpene, Fette und Öle | ||
| + | |- | ||
| + | |mittel | ||
| + | |polare Stoffe mit niedrigem Molekulargewicht | ||
| + | |Coffein, Nikotin, Cholesterin, Wasser, niedrige Fettsäuren, Alkohole, Wachse | ||
| + | |- | ||
| + | |keine | ||
| + | |stark polare Stoffe, unpolare Stoffe mit höherem Molekulargewicht | ||
| + | |Aminosäuren, Proteine, Kohlehydrate, Fettsäuren | ||
| + | |} | ||
| + | |||
| + | == Quiz == | ||
| + | Frage: | ||
| + | |||
| + | <div class="multiplechoice-quiz"> | ||
| + | |||
| + | Was versteht man unter "Extrahieren"? | ||
| + | (!Mischen) (!Absorbieren) (Herauslösen) (!Trocknen)(!Vereinigen) | ||
| + | |||
| + | </div> | ||
| + | |||
| + | |||
| + | Frage: | ||
| + | |||
| + | <div class="multiplechoice-quiz"> | ||
| + | Aus welchen drei '''wesentlichen''' Prozessschritten besteht ein Extraktionsprozess? | ||
| + | (!Kondensieren) (!Zentrifugieren) (Eindampfungsprozess) (Trocknungsprozess )(Extraktionsprozess)(!Brüden)(!Extraktionsgut) | ||
| + | |||
| + | </div> | ||
| + | |||
| + | |||
| + | Frage: | ||
| + | |||
| + | <div class="multiplechoice-quiz"> | ||
| + | |||
| + | Wozu dient das Extrahieren von Piperin? | ||
| + | (Nachweis für die Schärfe von Pfeffer) (!Nachweis für die Schärfe von Messern) (!Nachweis von Pinheads und Lightberries) (Nachweis eines gelblichen Feststoffes) (!Nachweis eines grünlichen Feststoffes) | ||
| + | |||
| + | </div> | ||
| + | == Internetseiten== | ||
| + | https://www.chemie-schule.de/KnowHow/Überkritisches_Kohlenstoffdioxid | ||
| + | |||
| + | {{SORTIERUNG:{{SUBPAGENAME}}}} | ||
| + | [[Kategorie:Techniker Schule Butzbach/Verfahrenstechnik]] | ||
Aktuelle Version vom 2. Februar 2021, 14:46 Uhr
Inhaltsverzeichnis |
Industrieller Extraktionsprozess
Definition
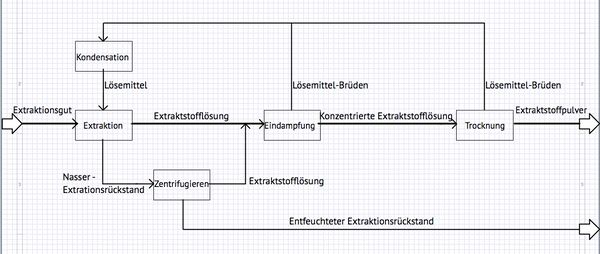
Bei dem Extraktionsprozess handelt es sich um ein Trennverfahren, bei dem mit Hilfe eines Lösemittels die löslichen Bestandteile (Extrakt) aus einem Feststoff (Extraktionsgut) heraus gelöst werden.
Das Grundfließbild zeigt die Prozessschritte und Stoffströme eines Industriellen Extraktionsverfahren. Im wesentlichen besteht der abgebildete Extraktionsprozess aus drei Prozessschritten:
- Dem eigentlichen Extraktionsprozess
- Dem Eindampfungsprozess
- Dem Trocknungsprozess
1. Extraktionsprozess
Das Lösemittel löst den Extraktstoff, sodass eine Extraktstofflösung entsteht. Die Extraktstoffklösung besteht aus dem Lösemittel und dem gelösten Extraktstoff. Die Extraktstofflösung wird nach dem Extraktionsprozess zum nächsten Prozessschritt, der Eindampfung, transportiert. Beispiele für Extraktionsprozesse:
- Kaffee kochen
- Tee kochen
- Kristallzuckerherstellung
- Bierherstellung
- Gemüsebrühe
2. Zentrifugierprozess (Nebenprozess)
Neben der Extraktstofflösung bleibt ein nasser Extraktionrückstand zurück. Diesem wird durch den Zentrifugierprozess die restliche Extraktstofflösung entzogen. Die im Zentrifugierprozess gewonnene Extraktstofflösung wird dem Stoffstrom zum Eindampfungsprozess zugeführt. Der zurückbleibende, entfeuchtete Extraktionsrückstand wird aus der Anlage ausgetragen. Im Fall von Kaffeepulver kann er für die Dampferzeugung als Brennstoff verwendet werden.
3.Eindampfungsprozess
Im Eindampfungsprozess wird die Extraktstofflösung aufkonzentriert. Das heißt der Extraktstofflösung wird durch ein thermisches Verfahren, dem Eindampfungsprozess, soviel thermische Energie zugeführt, dass das Lösemittel in der Extraktstofflösung verdampft. Der Anteil an Lösemittel in der Extraktstofflösung sinkt, während der Anteil des Extraktstoffes (Feststoffpartikel) zunimmt, da die Feststoffmenge gleich bleibt. Bei weniger Lösungsmittel ergibt sich damit eine höhere Konzentration.
Anlagenbeispiele: Robert-Verdampfer Die konzentrierte Extraktstofflösung wird dem Trocknungsprozess zugeführt.
4. Trocknungsprozess
Im Trocknungsprozess wird der konzentrierten Extraktstofflösung das restliche Lösemittel (Feuchtigkeit) durch ein thermisches Verfahren entzogen. Zurück bleibt in Pulverform der Extraktstoff.
Anlagenbeispiele: Walzentrockner, Sprühtrockner Ein Nachtrocknen kann mittels eines Wirbelschichttrockners geschehen.
5. Lösemittelkreislauf
Die Brüden, die aus dem Eindampfungsprozess (als Wasserdampf) und aus dem Trocknungsprozess (als feuchte Luft) hervorgehen, werden aufgefangen und zu einem Kondensator geleitet. In dem Kondensationsprozess gehen die Brüden von ihren gasförmigen Zustand wieder in einen flüssigen Zustand über. Das flüssige zurückgewonnene Lösemittel kann dem Extraktionsprozess wieder zugeführt werden.
Extraktionsprozess Labor
Pfeffer/ Piperin
Extraktion Soxhlet- Rückflusskühler
Piperin ist das am häufigsten vorkommende Alkaloid im Pfeffer und ist wahrscheinlich für die Schärfe des Pfeffers verantwortlich. Je nach Pfeffersorten beträgt der Anteil an Piperin 5-9%. Dieses Alkaloid ist ein gelblicher Feststoff, der eine Kristallstruktur besitzt, sehr lichtempfindlich ist und 1819 von Hans Christian Örsted erstmals isoliert wurde. Es ist im Fruchtfleisch und in der Zellwand enthalten.
Die Isolation von Piperin erfolgt mit Hilfe einer Soxhlet- Extraktionsapparat. Bei diesem Verfahren wird in einen Rundkolben ein Lösungsmittel (Diclormethan) gegeben, welche Piperin gut löst und in der Lage ist diesen aus Pfeffer zu extrahieren. Auf den Rundkolben wird ein Soxhlet- Aufsatz aufgesetzt, in dessen Extraktionsraum sich eine Extraktionshülse mit gemahlenem Pfeffer befindet. Auf den Soxhlet- Aufsatz wird anschließend ein Rückflusskühler gesetzt und das Lösungsmittel im Rundkolben bis zum Sieden erhitzt. Das Lösungsmittel verdampft, steigt über das Dampfleitungsrohr auf, kondensiert im Rückflusskühler und läuft in den Extraktionsraum, wobei es das im Pfeffer enthaltene Piperin herauslöst. Durch weiteres Zutropfen des Lösungsmittels, steigt der Flüssigkeitspegel bis zur Höhe des Heberohrs an. Wenn diese Höhe erreicht ist, wird das Lösungsmittel durch die auftretende Saughebewirkung in den Kolben zurück befördert. Dieser Prozess findet solange statt, bis das gesamte im Pfeffer enthaltene Piperin isoliert wurde. Dabei wird das im Rundkolben enthaltene Lösungsmittel bzw. Extrakt mit Hilfe eines Rotationsverdampfers konzentriert. Zurück bleib ein gelblicher Feststoff, das Piperin.
Extraktion mit überkritischem CO2
Überkritisches Kohlenstoffdioxid (auch superkritisches Kohlenstoffdioxid oder scCO2, von englisch "supercritical") ist Kohlenstoffdioxid in einem fluiden Zustand über seiner kritischen Temperatur und seinem kritischen Druck.
Eigenschaften
Im überkritischen Aggregatzustand hat Kohlenstoffdioxid deutlich andere Eigenschaften als unter Normbedingungen, die zwischen den Eigenschaften von Gas und Flüssigkeit liegen. So ist es genauso dicht wie eine Flüssigkeit, hat aber dieselbe Viskosität wie ein Gas.[1] Carbon dioxide pressure-temperature phase diagram deutsch
Überkritisches Kohlenstoffdioxid (auch superkritisches Kohlenstoffdioxid oder scCO2, von englisch "supercritical") ist Kohlenstoffdioxid in einem fluiden Zustand über seiner kritischen Temperatur und seinem kritischen Druck. Eigenschaften
Verwendung
Durch die leichte Verfügbarkeit, die Ungiftigkeit und die leichte Abtrennung von den gelösten Stoffen ist überkritisches Kohlenstoffdioxid ein vielversprechendes Lösungsmittel für vielfältige Anwendungen. Überkritisches Kohlenstoffdioxid ist dank seiner Fließfähigkeit eine überaus agile Substanz. Dadurch kann es in andere Stoffe eindringen und wird in der Industrie als Extraktionsmittel oder Destraktionsmittel (z. B. zur Entkoffeinierung von Kaffee) genutzt. Im Jahr 2007 wurden bereits ein Fünftel aller entkoffeinierten Kaffees durch Extraktion mit überkritischem Kohlenstoffdioxid hergestellt. Es wird aber auch für eine Vielzahl anderer industrieller Prozesse als Aufschäummittel, Kühlmittel und Lösungsmittel genutzt.
Die folgende Tabelle gibt einen Überblick über die Löslichkeit verschiedener chemischer Stoffklassen in fluidem CO2
| Löslichkeit | Substanzklassen | Lebensmittelinhaltsstoffe |
|---|---|---|
| gut | lipophile unpolare Komponenten, mittelpolare Komponenten von niedrigem und mittlerem Molekulargewicht | Aromen, Terpene, Fette und Öle |
| mittel | polare Stoffe mit niedrigem Molekulargewicht | Coffein, Nikotin, Cholesterin, Wasser, niedrige Fettsäuren, Alkohole, Wachse |
| keine | stark polare Stoffe, unpolare Stoffe mit höherem Molekulargewicht | Aminosäuren, Proteine, Kohlehydrate, Fettsäuren |
Quiz
Frage:
Was versteht man unter "Extrahieren"? (!Mischen) (!Absorbieren) (Herauslösen) (!Trocknen)(!Vereinigen)
Frage:
Aus welchen drei wesentlichen Prozessschritten besteht ein Extraktionsprozess? (!Kondensieren) (!Zentrifugieren) (Eindampfungsprozess) (Trocknungsprozess )(Extraktionsprozess)(!Brüden)(!Extraktionsgut)
Frage:
Wozu dient das Extrahieren von Piperin? (Nachweis für die Schärfe von Pfeffer) (!Nachweis für die Schärfe von Messern) (!Nachweis von Pinheads und Lightberries) (Nachweis eines gelblichen Feststoffes) (!Nachweis eines grünlichen Feststoffes)
Internetseiten
https://www.chemie-schule.de/KnowHow/Überkritisches_Kohlenstoffdioxid