Dieses Wiki, das alte(!) Projektwiki (projektwiki.zum.de)
wird demnächst gelöscht.
Bitte sichere Deine Inhalte zeitnah,
wenn Du sie weiter verwenden möchtest.
Gerne kannst Du natürlich weiterarbeiten
im neuen Projektwiki (projekte.zum.de).Unterrichtsreihe Radioaktivitaet und Aufbau der Materie
Diese Seite entspricht bis auf kleine Änderungen der Seite Vom_Universum_zum_Atomkern (gem. CC-BY-SA)
Größenordnungen - vom Universum zum Atomkern
Auf der Seite "Scale of the Universe" gibt es eine sehr gute Animation, in der man die Größenordnungen im Universum erforschen kann.
Längenbezeichnungen und wissenschaftliche Schreibweise
Weil in der Kernphysik mit sehr kleinen Längen umgegangen wird, bietet es sich an, die wissenschaftliche Schreibweise für sehr kleine Zahlen zu lernen. Bei der Gelegenheit bietet es sich an, die Schreibweise für sehr große Zahlen mit zu lernen. Dazu schreibt man eine Zahl mit nur einer Stelle vor dem Komma (hier 1,674.927.351) und verschiebt mit einem Trick das Komma um beliebig viele Stellen nach links oder rechts.
Der Trick ist, die Zahl mit einer Zehnerpotenz (hier 10−27 zu multiplizieren. Ist der Exponent negativ (so wie in unserem Beispiel), wandert das Komma nach links - und zwar um so viele Stellen wie der (Betrag des) Exponent angibt (hier 27). Unser Beispiel würde in der normalen Schreibweise also folgendermaßen aussehen: 0,000.000.000.000.000.000.000.000.001.674.927.351
Weil das blöd zu Schreiben ist, hilft man sich mit der Wissenschaftlichen Schreibweise (die auch Exponenten-Schreibweise genannt wird).
Wenn der Exponent der Zehnerpotenz positiv ist, dann wandert das Komma übrigens um so viele Stellen nach rechts, wie der (Betrag des) Exponent angibt. 1,7863 ⋅ 1012 ist also das gleiche wie 1.786.300.000.000
Wissenschaftliche Schreibweise
| größer
|
Angabe in Meter | alternative Angabe | wissenschaftliche Schreibweise | ein Beispiel |
|---|---|---|---|---|
| 1.000.000m | 1 ⋅ 106m | |||
| 1.000m | 1km | 1 ⋅ 103m | höchster Wasserfall | |
| 100m | 1 ⋅ 102m | ISS | ||
| 10m | 1 ⋅ 101m | Haus | ||
| 1,7m | 1,7 ⋅ 100m | Mensch | ||
| 1m | 1 ⋅ 100m | Sandkiste | ||
| kleiner
|
Angabe in Meter | alternative Angabe | wissenschaftliche Schreibweise | ein Beispiel |
| 0,1m | 1 ⋅ 10-1m | Maus | ||
| 0,01m | 1cm (Zentimeter) | 1 ⋅ 10-2m | Kaffeebohne | |
| 0,001m | 1mm (Millimeter) | 1 ⋅ 10-3m | Staubkorn | |
| 0,000.001m | 1μm (Micrometer) | 1 ⋅ 10-6m | Virus | |
| 0,000.000.001m | 1nm (Nanometer) | 1 ⋅ 10-9m | Molekül | |
| 0.000.000.000.1m | 1 ⋅ 10-10m | |||
| 0,000.000.000.01m | 1 ⋅ 10-11m | |||
| 0,000.000.000.001m | 1pm (Picometer) | 1 ⋅ 10-12m | ||
| 0,000.000.000.000.1m | 1 ⋅ 10-13m | |||
| 0,000.000.000.000.01m | 10fm (Femtometer) | 1 ⋅ 10-14m |
Das Auflösungsvermögen
Auge
Auf der Seite " Auflösungsvermögen#Auge![]() " in der Wikipedia wird erklärt, wie die Begrenzung des Auges zustande kommt. Ein Objekt, dass das Auge nicht auflösen kann, kann nicht mehr als ein einzelnes Objekt wahrgenommen werden. Ein Bild dieser feinen Auflösung lässt sich am gewöhnlichen Computerbildschirm nicht darstellen, da die Auflösung des Bildschirms grober ist, als das Auflösungsvermögen des Auges.
" in der Wikipedia wird erklärt, wie die Begrenzung des Auges zustande kommt. Ein Objekt, dass das Auge nicht auflösen kann, kann nicht mehr als ein einzelnes Objekt wahrgenommen werden. Ein Bild dieser feinen Auflösung lässt sich am gewöhnlichen Computerbildschirm nicht darstellen, da die Auflösung des Bildschirms grober ist, als das Auflösungsvermögen des Auges.
Die kleinsten mit bloßem Auge wahrnehmbaren Objekte haben (bei der Entfernung in der man ein Buch hält) etwa eine Größe von 1 ⋅ 10-4m.
Mikroskop
Das Auflösungsvermögen eines optischen Mikroskops ist durch die Wellenlänge des Lichts begrenzt. Die Wellenlänge ist eine Eigenschaft des Lichts, die u.a. für die Farbe des Lichts verantwortlich ist.
Die kleinsten mit einem optischen Mikroskop wahrnehmbaren Objekte haben etwa eine Größe von 1 ⋅ 10-7m.
Rasterelektronenmikroskop
Das Auflösungsvermögen eines Elektronenmikroskops ist ebenfalls begrenzt. Die kleinsten mit einem Elektronenmikroskop wahrnehmbaren Objekte haben etwa eine Größe von 1 ⋅ 10-10m.
Atomhülle und Atomkern
Die Größe eines Atoms und eines Atomkerns
Wie du bereits weißt, besteht ein Atom aus einem Kern und einer Atomhülle. Ein Atom ist dabei in etwa 1 ⋅ 10-10m groß, der Kern ist 10.000 kleiner!
Atomkerne
Jahrhunderte lang versuchten Gold aus anderen Stoffen herzustellen. Mit chemischen Reaktionen war dies jedoch nicht zu schaffen. Mittlerweile ist dies möglich (Goldsynthese), jedoch mit Energiekosten verbunden, so dass eine Herstellung sich gar nicht lohnt. Es bleibt aber prinzipiell die Frage, wie ist es möglich ein chemisches Element in ein anderes ?
Alle schwereren chemischen Elemente sind ursprünglich aus der Verwandlung von Wasserstoff zu und dann zu weiteren schwereren Kernen entstanden. Dies ist nur bei hohen Temperaturen, z.B. im Inneren der möglich. Mit Hilfe von hochspezialisierten Techniken heutzutage ist es möglich, eine ganze Reihe von Elementen künstlich herzustellen. Dies geschieht im Normalfall in (s. Bild rechts) oder in .
Zahlreiche Experimente in den letzten 100 Jahren haben eine Menge an völlig neuen Erkenntnissen über den Aufbau der kleinsten Teilchen gebracht. Bereits in den den 30er Jahren des vergangenen Jahrhunderts hat man zusätzlich zum Proton das als Hauptbestandteil des nachgewiesen.
Um die Anzahl der Protonen und Neutronen im Kern direkt anzugeben, wurde eine neue Schreibweisen eingeführt:
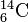 . Dabei bezeichnet die obere Zahl die Gesamtzahl der Nukleonen im Kern (also zusammen).
. Dabei bezeichnet die obere Zahl die Gesamtzahl der Nukleonen im Kern (also zusammen).
Die untere Zahl gibt die Anzahl der Protonen im Kern an. Sie ist damit ausschlaggebend für die des Elements und damit dessen Lage innerhalb des Periodensystems. Sie trägt deshalb die Bezeichnung . Die obere Zahl gibt die Zahl der Nukleonen an und gibt damit einen Hinweis auf die Masse des Kerns. Sie wird als bezeichnet.
TeilchenbeschleunigernAlchemistenumzuwandelnSonneKernreaktorenProtonen und NeutronMassezahlHeliumOrdnungszahlNeutronchemischen EigenschaftenAtomkernssehr hohen
Ergänze die folgenden Bilder um die Angaben zur Anzahl der Protonen, der Neutronen und der Bezeichnung des zugehörigen Elements. Gib auch die entsprechende Schreibweise an.
Zuordnung
Ordne die Anzahl der Protonen, Neutronen und Elektronen sowie die Elementbezeichnungen den jeweiligen Symbolen zu.
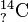
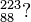
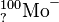
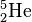
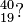
58 Neutronen43 Elektronen6 Elektronen8 NeutronenRadiumKohlenstoff6 ProtonenKaliumMolybdän21 Neutronen19 Protonen2 Protonen88 Protonen88 Elektronen2 Elektronen3 Neutronen145 Neutronen19 Elektronen42 ProtonenHelium
Kräfte zwischen Nukleonen
Wie du weißt, ziehen sich ungleichnamige Ladungen an, wohingegen gleichnamige Ladungen sich gegenseitig abstoßen. Damit ein Kern nicht auseinander gerissen wird, ist deshalb noch eine andere Kraft notwendig. Sie muss stärker als die elektirsche Kraft sein. Diese Kraft trägt die Bezeichnung "Kernkraft". Sie wirkt nur auf sehr kleine Entfernungen, nur dann wenn zwei Nukleonen (insbesondere zwei Protonen) direkt nebeneinander liegen.
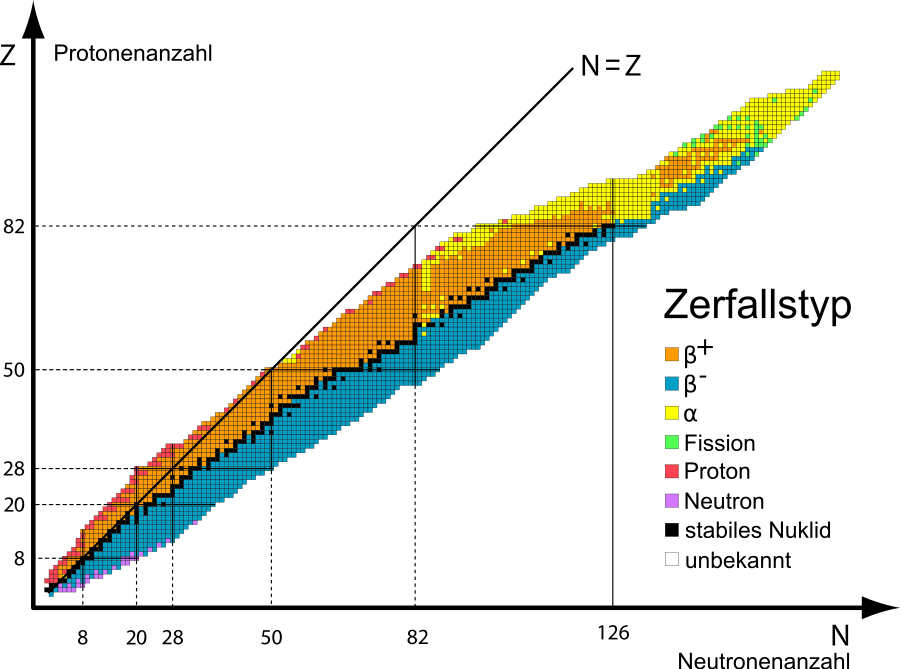
Vom Periodensystem zur Isotopenkarte
Aus der Chemie ist das Periodensystem der Elemente (oder kurz Periodensystem) bekannt. Das Periodensystem sortiert die Elemente nach und der Anordnung der Elektronen in den Elektronenschalen.
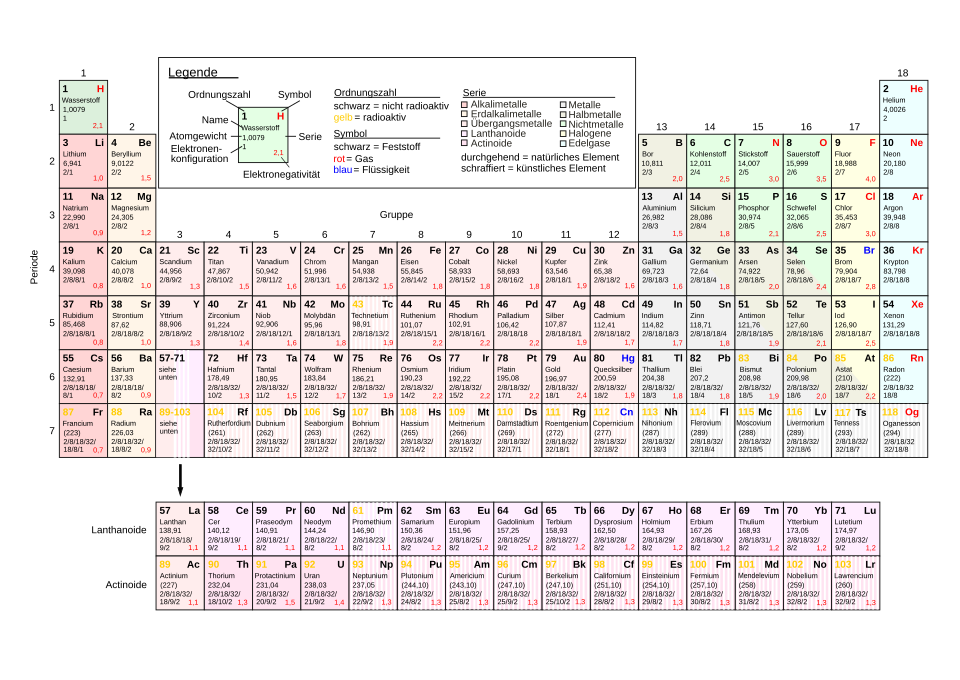
Für die Physik ist der genaue Kernaufbau sehr wichtig. Darüber gibt das Periodensystem aber keine Auskunft.
Nehmen wir an, wir wollen uns ein Heliumatom genauer anschauen. Aus dem Periodensystem kennen wir die bereits. Beim Helium sind es immer zwei. Außerdem können wir aus der Differenz aus der Massenzahl und der Ordnungszahl (=Anzahl der Protonen) auf die schließen. (Fast) jedes Atom besitzt auch Neutronen. Beim Helium sind es zwei Neutronen.
Aber es können auch Atome mit einer abweichenden Menge Neutronen vorkommen, z.B. statt zwei Neutronen nur ein Neutron. Wir sprechen dann von 3He und sagen .
3He und das gewöhnliche 4He sind zwei sogenannte des Elements Helium.
Jedes Element besitzt verschiedene . Die Isotopentafel stellt alle uns bekannten Isotope in einer Tabelle dar.
Dabei sind die Isotope so angeordnet, dass ihre Protonenanzahl auf der Y-Achse und ihre Neutronenzahl auf der X-Achse abgelesen werden kann.
Darüber hinaus sind die Isotope farbig markiert. Schwarz hinterlegte Atome sind stabil, sie .
Die anderen Farben zeigen die Art des Zerfalls an, mit der das zerfällt. Uns interessieren zunächst nur die beiden in der Natur am meisten vorkommenden Zerfälle: Der α-Zerfall und der β-Zerfall.
Isotopein der Regelzerfallen nichtAnzahl der NeutronenAnzahl der ProtonenAnzahl der ProtonenHelium-3IsotopeIsotop
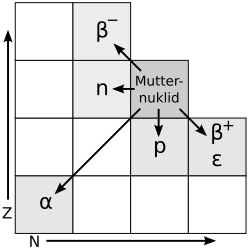
Zerfallsarten
Bestimmte Isotope sind . Das bedeutet, dass sie nach einer gewissen Zeit in zerfallen. Welches Isotop auf welche Art zerfällt, lässt sich nachweisen. aber ein einzelnes Isotop zerfällt, lässt sich .
In der Natur kommen vor allem zwei verschiedene Zerfallsarten vor: Der Alpha-Zerfall und der Beta-Zerfall.
In beiden Fällen stößt der Kern ein Teilchen ab und heraus. Wir bezeichnen diesen Vorgang als Alpha- bzw. Betastrahlung und schreiben α-Strahlung bzw. β-Strahlung. Beides sind .
Radioaktive Strahlung wirkt ionisierend (man spricht daher auch von ionisierender Strahlung). Das bedeutet, dass die Strahlung Atoms heraus schlagen kann, wenn das Atom der ionisierenden Strahlung ausgesetzt wird. So erklärt sich die zellschädigende Wirkung ionisierender Strahlung.
Menschen haben für radioaktive Strahlung (egal ob α-, β-, oder γ-Strahlung) . Es gibt aber Geräte, mit denen wir radioaktive Strahlung nachweisen können. Ein weit verbreitetes Gerät ist das Geiger-Müller-Zählrohr (auch Geiger-Zähler genannt). Das Funktionsprinzip des Geiger-Müller-Zählrohrs basiert auf der ionisierenden Wirkung der radioaktiven Strahlung.
kein Sinnesorgannicht stabilElektronen aus der Hülle einesradioaktive Strahlennicht vorhersagenschleudert es aus dem KernWannzwei kleinere Teile
α-Zerfall
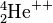 )) wird aus dem Kern „herausgeschossen“. Dabei des emittierenden (aussendenden) Kerns um 4, die Kernladungszahl ( = Ordnungszahl ) um 2. Es entsteht also ein .
)) wird aus dem Kern „herausgeschossen“. Dabei des emittierenden (aussendenden) Kerns um 4, die Kernladungszahl ( = Ordnungszahl ) um 2. Es entsteht also ein .Beispiel: 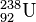 →
→ 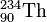 +
+ 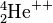 + Energie
+ Energie
Aufgrund ihrer starken, positiven Ladung haben Alphateilchen in Materie. Ihre Reichweite in Luft beträgt nur ca. 5 – 10 cm. Zur vollständigen Abschirmung reichen bereits aus.
α-Strahlung besteht aus elektrisch geladenen Teilchen, sie wirkt stark ionisierend.
Stoffe die α-Strahlung aussenden (sog. α-Strahler) sind vor allem dann für Menschen gefährlich, wenn diese Stoffe werden. Die α-Strahlung kann im inneren des Körpers schwere Schäden verursachen. Wirkt die Strahlung hingegen , so bietet bereits die oberste Hautschicht einen sehr guten Schutz vor der α-Strahlung. Eine Ausnahme bildet hierbei die Hornhaut des Auges, die bereits durch Alphastrahlung schwer geschädigt werden kann.
völlig anderes Atomeinige Blätter PapierEigenschaften der α-Strahlung:in den Körper aufgenommenverringert sich die Massenzahlnur eine sehr geringe Eindringtiefenur von außen
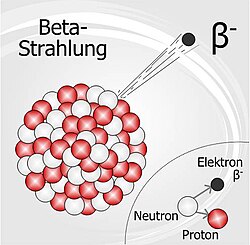
β-Zerfall
Bei einem β-Zerfall sendet ein Atomkern ein β-Teilchen aus. Das β-Teilchen ( ) kommt üblicherweise aber gar nicht im Kern vor! Es entsteht dadurch, dass sich ein Neutron in ein Proton und ein Elektron umwandelt. Das Proton verbleibt im Atomkern (die Kernladungszahl nimmt dadurch um eins zu, ) und das Elektron wird herausgeschossen.
Beispiel: 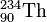 →
→ 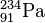 +
+ 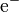 + Energie
+ Energie
Eigenschaften der β-Strahlung: β-Teilchen haben aufgrund der geringen Ladung eine in Materie. Je nach Anfangsenergie (Geschwindigkeit) haben β-Teilchen in Luft eine Reichweite von bis zu . Auch β-Teilchen sind elektrisch geladen. Sie wirkt schwach ionisierend. Bereits (z.B. Aluminium) reichen aus, um β-Strahlung praktisch vollständig abzuschirmen.
β-Strahlung kann auch bei äußerer Einwirkung auf den menschlichen Körper Zellen im Inneren des Körpers schädigen. Die schädigende Wirkung der β-Strahlung ist allerdings . Um die gleichen Schäden zu verursachen ist also eine höhere Strahlendosis erforderlich.
ein Elektronaus dem Kerndeutlich höhere Eindringtiefedie Massenzahl bleibt gleich!nicht so stark wie bei der α-Strahlungmehreren Meternwenige Millimeter Metall
γ-Strahlung
γ-Strahlung ist (wie Licht oder Röntgenstrahlung) eine . Sie tritt in der Regel als Folge vom α- und β-Zerfall auf. Bei diesen Zerfällen wird Energie vom Atomkern abgegeben. Diese Energie wird sowohl in Form von γ-Strahlung als auch in Form von Wärme vom Atom abgegeben. Es gibt für das Auftreten von γ-Strahlung auch andere Ursachen, z.B. andere Kernreaktionen.
Eigenschaften von γ-Strahlung: γ-Strahlung wirkt . Die Abschirmung von γ-Strahlung ist . Grundsätzlich wird die abschirmende Wirkung mit wachsender Dicke der Barriere und mit zunehmender Massenzahl des abschirmenden Materials größer.
sehr schwierigelektromagnetische Welleschwach ionisierend
α-Zerfall in der Nuklidkarte
Der α-Zerfall (sprich: Alpha-Zerfall) lässt sich in der Nuklidkarte verfolgen. Der Kern verliert dabei zwei Protonen und zwei Neutronen (also einen Helium-Kern (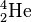 )). Um vom Ausgangs-Isotop zum Ziel-Isotop zu gelangen geht man zwei Zeilen nach unten (für die verlorenen Protonen) und zwei Spalten nach links (für die verlorenen Neutronen).
)). Um vom Ausgangs-Isotop zum Ziel-Isotop zu gelangen geht man zwei Zeilen nach unten (für die verlorenen Protonen) und zwei Spalten nach links (für die verlorenen Neutronen).
β-Zerfall in der Nuklidkarte
Auch der β--Zerfall (sprich: Beta-Zerfall) lässt sich in der Nuklidkarte verfolgen. Der Kern wandelt ein Neutron in ein Proton (und ein Elektron) um. Um vom Ausgangs-Isotop zum Ziel-Isotop zu gelangen geht man eine Zeilen nach links (für das verschwundene Neutron) und eine Spalte nach oben (für das dazu gewonnene Proton).
Weitere Informationen in der Nuklidkarte
Die farbige Kennzeichnung der Isotope (oder Nuklide) verrät etwas über die Zerfallsart. Für uns sind drei Farben wichtig:
- schwarzer Hintergrund: Das Isotop ist stabil. Es zerfällt nicht weiter, es ist nicht radioaktiv.
- sehr hell grauer Hintergrund: Das Isotop zerfällt über den β-Zerfall. Es handelt sich daher um einen β-Strahler.
- sehr dunkel grauer Hintergrund: Das Isotop zerfällt über den α-Zerfall. Es handelt sich daher um einen α-Strahler.
Bei den stabilen Isotopen steht eine Prozent-Angabe unter dem Element-Symbol. Sie gibt den des Isotops in dem an.
Bei den radioaktiven Isotopen steht eine Zeit unter dem Element-Symbol. Sie gibt die des Isotops an.
eines Isotops beschreibt die Zeit die vergeht, bis von einer gegebenen Menge des Isotops zerfallen ist (sich also in ein anderes Element umgewandelt hat). Nach einer Halbwertszeit ist von den ursprünglichen vorhandenen Isotopen übrig. Nach einer weiteren Halbwertszeit hat sich die restliche Menge des Isotopes usw.
erneut halbiertprozentualen AnteilHalbwertszeitdie Hälfte der Kernenoch die HälfteDie Halbwertszeitnatürlich vorkommendem Element
Aufgabe 1: Interaktive Zerfallsgleichungen (dwu)
Aufgabe 2: Erläutere, warum es beim Gamma-Zerfall keine Gleichung gibt, die mit den Gleichungen zum Alpha- bzw. Beta-Zerfall vergleichbar wäre.
Zerfallsreihe
Ergänze die fehlenden Zerfallsprodukte der Neptunium-Zerfallsreihe
| Uran-238 |
| -> Thorium-234 |
| -> |
| -> |
| -> |
| -> |
| -> |
| -> |
| -> |
| -> |
| -> |
| -> |
| -> |
| -> |
| -> Blei-206 |
Ionisierende Strahlung
In den Jahren 1885/86 wurden zwei Strahlungsarten entdeckt. Durch Wilhelm Conrad Röntgen die X-Strahlung und durch Herni Becquerell die Alpha und Beta-Strahlung. Beide Strahlenarten haben Auswirkungen auf die menschliche Gesundheit, beide haben die Eigenschaft, dass sie Moleküle – insb. die im menschlichen Körper – ionisieren können.
Wiederhole aus dem Chemieunterricht, was man unter dem Begriff der Ionisation von Molekülen versteht. Erstelle dann eine kurze Zusammenfassung.
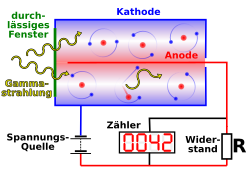
Geiger-Müller-Zähler
Da der Mensch kein Sinnesorgan für die ionisierenden Strahlen hat, musste man Vorrichtungen entwickeln, mit denen man diese Strahlungsarten nachweisen und ggf. auch messen kann. Deren Funktionsprinzip beruht häufig auf der ionisierenden Wirkung dieser Strahlen. So. z.B im Geiger-Müller-Zählrohr.
Aufgabe: Erkundige dich über die Funktionsweise des Geiger-Müller-Zählrohrs und ergänze den nachfolgenden Text:
Das Zählrohr ist gefüllt. Durch eine kleine Öffnung, die mit einer bedeckt ist, können radioaktive Strahlen in das Innere des Zählrohrs gelangen. Innerhalb des Zählrohrs befindet sich ein dünner Draht. Zwischen dem Draht und der äußeren Hülle des Zählrohrs wird eine angelegt. Gelangen nun radioaktive Strahlen in das Innere des Rohrs, so sie die Moleküle des Gases, es entstehen dann Ionen (und Elektronen), die sich - je nach Ladung - zu dem Draht bzw. zu dem Gehäuse mit einer bewegen. Auf ihrem Weg stoßen sie auf andere Moleküle, die bei dem Zusammenstoß ebenfalls werden. Es entsteht eine , die sich erst an dem Draht (oder dem Gehäuse) entlädt. Das Messgerät registriert dann eine , die in einem angeschlossenen Lautsprecher als kurzes hörbar gemacht wird.
hohen Geschwindigkeitionisiertpositive und negativehohe SpannungionisierenKnackendünnen FolieLawine von Teilchenmit einem GasVeränderung der Spannung
Nulleffekt
Nach dem Einschalten des Zählrohrs kommt es zu der Anzeige von mehreren radioaktiven Impulsen pro Minute. Wo aber kommen die auslösenden Strahlen her?
Aufgabe: Erkundige dich, wie diese sogenannte Nullrate zustande kommt. Fasse die auslösenden Quellen in drei Gruppen in Form einer Mindmap
| Kosmische Strahlung | ||
| Umwelteinflüsse | ||
| Terrestrische Strahlung | Zivilisatorische Einflüsse |
Weitere Hilfen bei Leifi
Kleine Rechenaufgabe: Wie du bereits weißt, ereignen sich im Geiger-Müller-Zähler einige Zerfälle pro Minute. In fast allen Fällen, sind die radioaktiven Strahlen durch das ca. 1cm² große Fenster des Zählers in das Rohr gelangt. Berechne, wie viele radioaktive Strahlen auf die Haut eines Menschen pro Minute gelangen (beim Erwachsenen hat die Haut die Fläche von ca. 2m²)
Wirkung der radioaktiven Strahlung auf den Menschen
(in Anlehnung an Wikipedia: Strahlenbiologie)
Empfehlenswerter Einstieg als Film: Quarks & Co: Mensch gegen Strahlung, Minute 6-14.
Die Untersuchung von Wirkungen ionisierender Strahlung auf Lebewesen ist die Hauptaufgabe der StrahlenbiologieIonisierende Strahlen beeinflussen Körperzellen durch der Moleküle. Im Allgemeinen sind dabei nicht die wenigen direkten Treffer an den Makromolekülen, sondern überwiegend die von Bedeutung. Die Radikale oxidieren wichtige zelluläre Makromoleküle und stören deren Funktion.
Dabei ist nur der der eingestrahlten Energie wirksam. Eine Strahlung kann durch die Energiemenge (die ein Strahlungsteilchen pro Mikrometer abgibt) charakterisiert werden.
In der Strahlenbiologie wird stattdessen auch die relative biologische Wirksamkeit verwendet, ein Faktor, der die im Vergleich zu 250-kV-Röntgenstrahlen angibt.
Strahlenschäden an Biomolekülen (Proteinen/Lipiden) können , ihre Auswirkungen auf die Zellfunktionen sind minimal.
Dagegen führen Radikalreaktionen mit der DNA (Erbsubstanz) manchmal zum , da jede Zelle nur über zwei Kopien verfügt und die Reparaturmechanismen begrenzte Kapazität haben.
Die meisten Strahlenfolgen sind erst nachweisbar, das heißt, dass Strahlung in der Größenordnung der natürlichen Hintergrundstrahlung gilt in dieser Beziehung als ungefährlich.
Neben der Mutation und dem Zelltod kommt es in Säugetierzellen nach Bestrahlung auch zu Verzögerungen des Zellzyklus, und zuvor unbegrenzt teilungsfähige Stammzellen und Krebszellen können nach Bestrahlung ausdifferenzieren und ihre Klonbildungsfunktion verlieren.
Unterschiedliche Gewebe sind . Je niedriger der Sauerstoffpartialdruck im Gewebe, desto unempfindlicher ist es auf ionisierende Strahlen.
Auch der makroskopische Aufbau der Organe spielt eine Rolle: Linear aufgebaute Organe wie der Dünndarm oder das Rückenmark sind wesentlich stärker gefährdet als parallel aufgebaute wie z. B. Drüsen.
Auf Basis der Spätfolgen, die wesentlich gefürchteter sind als die frühe Strahlungswirkung, hat man für die meisten Organe und Gewebe definiert. Beispielsweise liegt die TD5/5 der Augenlinse für die Linsentrübung(grauer Star) bei 10 Gy
Die Empfindlichkeit von Tumoren gegenüber ionisierender Strahlung ist in der Regel höher als die von gesunden Geweben. Sie sind gekennzeichnet durch eine kürzere Zellzykluszeit (< 2 Tage) und einen höheren Anteil an sich teilenden Zellen ( > 40 %). Die Verträglichkeit von Strahlung ist höher, wenn die Dosisleistung (= Dosis pro Zeiteinheit) gering ist oder die Strahlung auf viele kleine Behandlungen verteilt wird. Das liegt an den sofort nach Strahleneintritt anlaufenden Gewebereaktionen:
- Reparatur (enzymatische Korrektur der Einzel- und Doppelstrangbrüche und Basenfehler in der DNA)
- Redistribution (Fortsetzung der unterbrochenen Zellzyklen, sodass wieder Zellen aus allen Phasen vorliegen)
- Reoxygenierung (erhöhte Sauerstoffversorgung im Gewebe)
- Repopulation (Nachwachsen von Zellen)
Bildung von Radikale im GewebeSchädlichkeit einer StrahlungZelltod oder zur Mutationab einer gewissen MindestdosisToleranzdosenIonisationWachstumsfraktionproblemlos ertragen werdenunterschiedlich strahlenempfindlichim Gewebe absorbierte Anteil
Die Menschen und andere Lebewesen haben gelernt mit der Radioaktivität, die in der Natur vorhanden ist zu leben. Die Zellen können evtl. Schäden ohne weiteres reparieren. Voraussetzung ist allerdings, dass die Zahl der Reparaturen nicht zu groß ist. Sollten die Menschen der radioaktiven Strahlung ausgesetzt werden, weil das für ihre Arbeit, für die Gesundheit oder wegen anderer Gründe notwendig ist, so muss stets darauf geachtet werden, dass die (unerwünschte) Strahlendosis minimal ist.
Aufgabe: Recherchiere, wo kommen Menschen mit einer erhöhten Dosis der radioaktiven Strahlung in Kontakt.
. . . . . .
Um herauszufinden, wie man sich vor einer übermäßigen Strahlendosis schützen kann, ist es nützlich etwas über Eigenschaften der radioaktiven Strahlen herauszufinden:
- Finde heraus, wie sich der Abstand des Zählerrohr von der Quelle der radioaktiven Quelle auf die Anzahl der gemessenen Impulse auswirkt.
- Finde heraus, wie sich die Zählrate mit Hilfe des Abschirmmaterials, das zwischen das Zählrohr und die Strahlungsquelle gestellt wird verändert. Notiere deine Ergebnisse in der Form einer Tabelle:
| Nullrate | gemessene Intensität |
| ohne Abschirmmaterial | |
| 1 Blatt Papier | |
| 2 Blatt Papier | |
| 4 Blatt Papier | |
| 1 dünne Aluminiumplatte | |
| 2 dünne Aluminiumplatte | |
| 1 dünne Bleiplatte |
Fasse deine Beobachtungen zusammen:
Verhalten der radioaktiven Strahlen im Magnetfeld.
(Vgl. hierzu z.B. Graphik im Buch DornBader "Physik" auf Seite 219)
Beschrifte die Strahlen. Überlege dir zunächst auf Grund welchen physikalischen Gesetzes man eine Aussage über die Bewegung von elektrisch geladenen Teilchen in einem Magenfeld treffen kann.
Aufgabe:Was kann man auf der Grundlage obigen Beobachtungen über die Möglichkeiten des Schutzes vor radioaktiven Strahlung sagen? . . . . .
Die Ablenkung der Strahlen durch einen Magneten spielt keine Rolle in den Anwendungen auf der Erde, dennoch war und ist diese Eigenschaft enorm wichtig für das Entstehen von Leben auf unserem Planeten.
Erkundige dich, was mit dem Magnetschild der Erde gemeint ist und was das mit der radioaktiven Strahlung zu tun hat. . | . . . .
Praktischer Strahlenschutz
(aus Wikipedia)
Die von einer Strahlenquelle gegebener Art empfangene Dosis hängt ab
- von der Aktivität der Quelle,
- von der Aufenthaltsdauer nahe der Strahlenquelle,
- vom Abstand zur Strahlenquelle (außer bei sehr ausgedehnten Strahlenquellen),
- von der Abschirmung durch Materie zwischen Quelle und Person.
Maßnahmen, um unvermeidliche Belastungen beim Umgang mit Strahlenquellen möglichst gering zu halten, sind daher:
- , die mit kleinstmöglicher Exposition des Personals das erwünschte Ergebnis erreicht,
- Vorausschauende Organisation und Planung des Arbeitsvorgangs, um die ,
- möglichst großer , beispielsweise durch Benutzung langer Greifzangen,
- Benutzung geeigneter .
Expositionsdauer kurz zu haltenAuswahl von BedingungenBestrahlungsabstandAbschirmungen
Als Merksatz wird häufig von den „A-Regeln“ gesprochen, die den sicheren Umgang mit Strahlenquellen verdeutlichen:
- Aktivität begrenzen,
- Aufenthaltsdauer minimieren,
- Abstand halten,
- Abschirmung verwenden,
- Aufnahme vermeiden.
Ionisierende Strahlung hat im Vergleich zu anderen Arbeitsplatzrisiken (etwa luftgetragenen Giften oder Mikroorganismen) den Vorteil, dass sie mit kleinen, überall einsetzbaren Geräten Dosimetern leicht messbar ist.
Welche Menge an radioaktiver Strahlung ist überhaupt zulässig?
Diese Frage lässt sich nicht mit einem einfachen Wert beantworten, da es sich je nach Strahlungsart und je nach bestrahlten Organ um verschiedene zulässige Größen handelt.
Man unterscheidet prinzipiell zwischen:
- Strahlendosis
- Äquivalentdosis und
- Effektivdosis
Strahlendosis: bezeichnet Größen, die die Auswirkung ionisierender Strahlung in Materie beschreiben. Dosisenergie oder Energiedosis ist die von der Strahlung pro Masseeinheit an das Material abgegebene Energie, Dosisleistung die pro Masseeinheit abgegebene Leistung.
Die entscheidende Größe für die Wirkung von Strahlung ist die geleistete Arbeit in Materie, also die in ein Volumen übertragene Energie (Einheit: J = Joule).
Energiedosis Die Energiedosis ist die über die gesamte Bestrahlungsdauer aufgenommene Energie bezogen auf die bestrahlte Masse. Man unterscheidet physikalische Dosisgrößen für verschiedene Anwendungsbereiche:
Äquivalentdosis ist eine Dosisangabe für ionisierende Strahlung, die im Strahlenschutz verwendet wird. Sie berücksichtigt neben der übertragenen Energiedosis auch die relative biologische Wirksamkeit (RBW) der verschiedenen Strahlenarten. Beispielsweise sind bei gleicher Energiedosis Alphateilchen um ein Vielfaches wirksamer als Photonen der Gammastrahlung oder Röntgenstrahlung.
Um ein geeignetes einheitliches Maß für alle Strahlenarten und die Wirkung ihrer Expositionen zu erhalten, definiert man für jede Strahlenart Wichtungsfaktoren. Der Wichtungsfaktor drückt die Vielfachheit der Wirksamkeit im Vergleich mit einer Bezugsstrahlung (mit Wichtungsfaktor 1) aus. Gewichtet wird die Energiedosis. Eine gewichtete, d. h. mit dem Wichtungsfaktor multiplizierte Energiedosis wird Äquivalentdosis genannt. Äquivalentdosen jeder Strahlenart können in ihrer Wirkung direkt miteinander verglichen und durch Vergleich mit einer dosisgleichen Exposition der Bezugsstrahlung leicht bewertet werden.
Die effektive Dosis oder früher auch effektive Äquivalentdosis[1] ist ein Maß für die Strahlenexposition des Menschen. Zusätzlich zur Organdosis und zur Äquivalentdosis, welche bereits die unterschiedliche Wirksamkeit der verschiedenen Strahlungsarten (z. B. Alpha-, Beta-, Gamma-, Röntgenstrahlung- oder Neutronenstrahlung) miteinbeziehen, berücksichtigt die effektive Dosis auch die unterschiedliche Empfindlichkeit der Organe gegenüber ionisierender Strahlung. Die Haut des Menschen ist z. B. weit weniger empfindlich gegenüber einer Strahlenexposition als verschiedene innere Organe.
Um diese Unterschiede zu berücksichtigen, wird durch die Bestimmung einer effektiven Dosis das Risiko für das Auftreten stochastischer Wirkungen bei Exposition einzelner Organe und Gewebe oder des ganzen Körpers bewertet.
Zur Berechnung der effektiven Dosis 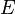 werden die Organdosen HT mit den Gewebe-Wichtungsfaktoren wT (siehe unten) des Organs T multipliziert. Die Summe der so gewichteten Organdosen ergibt die effektive Dosis:
werden die Organdosen HT mit den Gewebe-Wichtungsfaktoren wT (siehe unten) des Organs T multipliziert. Die Summe der so gewichteten Organdosen ergibt die effektive Dosis:
-
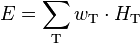 .
.
Die Einheit der effektiven Dosis ist ebenso wie die der Organdosis das Sievert, Kurzzeichen Sv.
Gewebe-Wichtungsfaktoren werden für die weltweite Verwendung von der Internationalen Strahlenschutzkommission (ICRP) vorgeschlagen. Die folgende Tabelle zeigt Vorschläge, die 1991 und 2007 veröffentlicht wurden:
| Organe und Gewebe | ICRP 60 (1990)[2] | ICRP 103 (2007)[3] |
| Keimdrüsen | 0,20 | 0,08 |
| Knochenmark (rot) | 0,12 | 0,12 |
| Dickdarm | 0,12 | 0,12 |
| Lunge | 0,12 | 0,12 |
| Magen | 0,12 | 0,12 |
| Blase | 0,05 | 0,04 |
| Brust | 0,05 | 0,12 |
| Leber | 0,05 | 0,04 |
| Speiseröhre | 0,05 | 0,04 |
| Schilddrüse | 0,05 | 0,04 |
| Haut | 0,01 | 0,01 |
| Knochenoberfläche | 0,01 | 0,01 |
| Speicheldrüsen | nicht definiert | 0,01 |
| Gehirn | nicht definiert | 0,01 |
| übrige Organe und Gewebe | 0,05 | 0,12 |
| Summe | 1,00 | 1,00 |
Halbwertszeit
Atombombenabwürfe und Kernreaktorunglücke
Gegen Ende des 2. Weltkrieges kam es zum Einsatz von sog. Atombomben über den japanischen Städten Hiroshima und Nagasaki. Dabei wurde eine Menge radioaktiver Strahlung freigesetzt. Nichtsdestotrotz sind diese Städte sehr schnell wieder aufgebaut worden und die Menschen und andere Lebewesen scheinen dort ohne größere Risiken leben zu können. Bei den Kernreaktorkatastrophen von Tschernobyl und Fukushima weiß man allerdings, dass ein Leben dort noch Jahrzehnte nur mit der radioaktiven Gefahr möglich sein wird. Dieses hängt mit der Dauer zusammen, welche die radioaktiven Materialien brauchen um soweit zu zerfallen, dass deren Strahlung nicht mehr bedrohlich ist. Diese Dauer ist jedoch nicht bei allen Stoffen gleich und schwankt zwischen einigen Mikrosekunden und Milliarden von Jahren.
Recherchiere zuerst, welche Stoffe in Hiroshima und welche in Fukushima für die Erzeugung der radioaktiven Strahlen verantwortlich waren. Nach wie vielen Jahren zerfallen diese jeweils?
Veranschaulichungen zur Halbwertzeit
Wie du aus der Isotopen-Tabelle erkennen kannst, zerfallen verschiedene Nuklide in unterschiedlichen Zeiten.
Aufgaben: # Nach welcher Zeit ist ein Gramm Uran-233 zur Hälfte zerfallen? # Wie könnte man den zufälligen Zerfall mit Würfeln (oder Lego-Klötzchen) nachbauen? # Welche Kurve ergibt die Anzahl der noch nicht zerfallen Kerne (evtl. Excel)? # Erkundige dich, wie man die Halbwertzeit in dem Ionisationskammer-Versuch demonstrieren kann?
Halbwertzeit nach Wikipedia
Halbwertzeit (abgekürzt , Formelzeichen meist 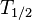 ) ist die Zeitspanne, nach der die der zerfallen ist. Sie hängt noch von der bereits verstrichenen Zeit ab.
) ist die Zeitspanne, nach der die der zerfallen ist. Sie hängt noch von der bereits verstrichenen Zeit ab.


Man kann somit nur noch die Hälfte der Aktivität des Radionuklids messen. 50 % der Atomkerne haben sich unter in ein anderes umgewandelt; dieses kann seinerseits ebenfalls radioaktiv sein oder nicht. Für jedes Nuklid ist die Halbwertszeit eine , die sich lässt.
Die Halbierung gilt allerdings nur als statistischer Mittelwert. Man findet sie umso genauer bestätigt, je mehr nicht zerfallene Atome die betrachtete Probe noch enthält. Der Zeitpunkt der Umwandlung eines einzelnen Atomkerns werden, nur die der Umwandlung pro Zeiteinheit kann angegeben werden. Die Wahrscheinlichkeit, dass ein betrachteter einzelner Kern sich innerhalb der ersten Halbwertszeit umwandelt, beträgt 50 %, dass er sich innerhalb von zwei Halbwertszeiten umwandelt, 50 % + 25 % = 75 %, bei drei Halbwertszeiten 50 % + 25 % + 12,5 % = 87,5 % usw. (Wikipedia: Halbwertszeit)
Es gibt radioaktive Halbwertszeiten im Bereich von weniger als einer bis zu einigen Jahren. Polonium-212 beispielsweise hat 0,3 µs Halbwertszeit, Tellur-128 dagegen etwa 7·1024 (7 Quadrillionen) Jahre.
Eng verknüpft mit der Halbwertszeit eines Radionuklids ist seine spezifische Aktivität, also die , ausgedrückt z. B. in Becquerel pro Milligramm: . Dabei bezeichnet die Aktivität im Allgemeinen , die SI-Einheit der Aktivität ist das Becquerel (Bq). 1 Bq entspricht einem Kernzerfall .
Erst Ende des 20. Jahrhunderts sind einige früher als stabil geltende Nuklide als „entlarvt“ worden, zum Beispiel 149Sm, 152Gd (beides Lanthanoide), 174Hf, 180W und 209Bi mit Halbwertszeiten von bis zu einigen Trillionen Jahren. Die Aktivität ist bei so langen Halbwertszeiten entsprechend gering und nachweisbar.
MikrosekundeNuklidextrem langlebige Radionuklideweder von der AnfangsmengeQuadrillionenAussendung ionisierender StrahlungBq/mgHWZnicht beeinflussendie Anzahl der Kernzerfälle pro ZeiteinheitWahrscheinlichkeitHälfteursprünglichen Substanzpro Sekundefeste Größekann NICHT vorhergesagtAktivität pro Massenur mit großem Aufwand
Radiokarbonmethode
in Anlehnung an: http://wiki.zum.de/wiki/Unterrichtsreihe_Kernphysik/Radiokarbonmethode gem CC-BY-SA-3.0
Wie du bereits weißt, kommt jedes chemische Element in der Natur mit unterschiedlich vielen Neutronen vor. Wir bezeichnen die verschiedenen Erscheinungsformen eines Elements als 'Isotope dieses Elements. Ein Beispiel: Natürlich vorkommender Wasserstoff (gemeint ist natürlich nur der Kern) besteht zu 99,985% aus Isotopen mit einem Proton und ohne Neutronen. Zu 0,015% besteht das Wasserstoffatom jedoch aus einem Proton und einem Neutron! Dieses Wasserstoffisotop wird auch als Deuterium bezeichnet.
Künstlich lässt sich sogar Wasserstoff mit zwei Neutronen erzeugen. Wir bezeichnen dieses Isotop als Tritium.
Wir kennen 9 verschiedene Kohlenstoff-Isotope. Wie die meisten anderen Isotope haben diese aber keine eigenen Namen. Wir sprechen stattdessen von C12 (sprich: C-zwölf oder Kohlenstoff 12). Kohlenstoff kommt (teilweise künstlich erzeugt) als C9, C10, ... C16 und C 17 vor. In der Natur finden wir vor allem C12, C13 und C14.
C14 ist etwas besonderes, denn es verändert sich nach einiger Zeit. Ein Neutron zerfällt in zwei andere Teilchen: Ein Proton und ein Elektron!
Wie du weißt, wird dieser Vorgang als Beta-Zerfall bezeichnet. Es gibt sehr viele verschiedene Isotope die nach einer gewissen Zeit einen Beta-Zerfall ausführen. Das C14 Isotop ist allerdings deswegen so besonders, weil es in allen Lebewesen in einem bestimmten Verhältnis vorhanden ist. In der Natur kommen drei Isotope des Kohlenstoffs vor: 12C, 13C, 14C. Isotopenuntersuchungen zeigen, dass der Anteil am Gesamtkohlenstoffgehalt in der Luft für 12C etwa 98,89 %, für 13C etwa 1,11 % und für 14C 0,000.000.000.1 % beträgt. Auf 1.000.000.000.000 (1 Billion) 12C-Kerne kommt so statistisch nur ein einziger 14C-Kern.
14C wird ständig durch Kernreaktionen in der oberen Schicht der Erdatmosphäre neu gebildet. Zwischen ständiger Neubildung und ständigem Zerfall bildet sich ein ungefähres Gleichgewicht aus.
Menschen, Tiere und Pflanzen nehmen es mit der Nahrung (bzw. Nährstoffen) auf. Stirbt die Pflanze ab, kann sie kein weiteres C14 mehr aufnehmen und die C14-Konzentration nimmt langsam ab.
Die Nachweisgrenze von 14C liegt bei 1 Teil pro Billiarde (1.000.000.000.000.000), entsprechend einer Konzentration von etwa einem Tausendstel der Menge an 14C in einer frischen Probe und wird durch Beschränkungen der Messgeräte sowie in sehr geringen Mengen vorhandenes „Untergrund 14C“ aus anderen Quellen bestimmt. Durch den radioaktiven Zerfall nimmt die Menge von 14C mit der Zeit ab. Nach 10 Halbwertszeiten, (das sind für C14 ca. 57.300 Jahre), liegt der Anteil unterhalb der Nachweisgrenze. Die Radiokarbonmethode ist daher nur für jüngere Proben anwendbar. Für die Altersbestimmung erdgeschichtlicher Fossilien z. B. in Bernstein, Braunkohle, Steinkohle oder Diamanten, ist sie unbrauchbar.
Atommüll
Erkundige dich, welche Probleme der sogenannte Atommüll bereitet. Welche Probleme muss man bezüglich seiner Lagerung beachten? Für wie viele Jahre müssen entsprechende Lagerstätten gemietet werden?
Strahlenmedizin
Strahlen schaffen Durchblick
Der wohl bekannteste Einsatz der Radioaktivität in der Medizin ist die Aufnahme von Röntgenfotos des menschlichen Körpers. Erkundige dich mittels des Films Strahlen schaffen Durchblick (Planet Schule) wie Röntgenfotos zustande kommen und was man wie erkennt.
Kurze Zusammenfassung des Films:
Röntgengeräte und Röntgenstrahlung
Heute kann man sich gar nicht mehr aus dem Alltag wegdenken. Ob am Flughafen oder in der Medizin, überall sind sie fest in unseren Alltag integriert. Alles begann vor über Jahren: Am 8.11.1895 entdeckte (1845-1923), bei einem seiner Experimente mit einer , die heutige . Dabei leuchteten Kristalle auf, wobei sich die Strahlen auch nicht durch Abdunkeln aufhalten ließen. So stellte er fest, dass die Strahlen, welche Wilhelm Röntgen Materialien Physik-Nobelpreis
Röntgenstrahlung entsteht in einer Glasröhre, wobei zwischen einer erhitzten und einer Anode eine hohe erzeugt wird. Dabei treten die aus der Glühkathode aus und treffen stark beschleunigt auf den Pluspol der . Sie dringen durch die ein, werden aber durch den abgebremst, wobei wiederum Energie freigesetzt wird (meist , ca. 1% in Form von Röntgenstrahlung). Zum Teil wird diese in Form von Röntgenstrahlung, auch genannt, aber auch in Form von mit besonderes großer Intensität und bestimmter Energie, welche vom Material der Anode abhängig ist, abgegeben.
Wenn die Elektronen in den kernnahen Bereich der Anode gelangen, schlagen sie Elektronen aus den inneren heraus und die anderen Elektronen der Schalen müssen aufrücken. Dabei kommt es zu der Entstehung eines . Da sich dabei der energetische Zustand erhöht, werden Röntgenstrahlen ausgesendet, wodurch der Energiezustand der Anode niedriger wird. Heutzutage findet man die Röntgenstrahlung zum Beispiel bei der , wo dann das rotierende Gerät des Körpers macht. Dies geschieht durch das Aussenden der Strahlung, wodurch ein spezielles entsteht. Dann fangen die Strahlung auf und der Computer bekommt die Informationen in Daten umgewandelt.
fluoreszierendeAnodebeschleunigtendurchdringen können. Dadurch, dass er als erster die Hand seiner Frau röntgte, wurde er weltberühmt und erhielt 1901 den erstenRöntgenstrahlungcharakteristischeGasentladungsröhre100ComputertomographieäußerenKathodeRöntgengeräteElektronenRöntgenstrahlungDetektorenHelligkeitsmusterWilhelm Conrad RöntgenQuerschnitteAtomkernWärmeenergieX-Strahlen‘‘‘ nannte, unterschiedlichsteBremsstrahlungSchalenRöntgenquantsluftleerenSpannung.Atomhülle
Röntgenpass
Recherchiere, was ein Röntgenpass ist und welchem Zweck er dient
Weitere medizinische Anwendungen der Radioaktivität
Außerdem gibt es aber noch zahlreiche andere Anwendungen der Radioaktivität in der Medizin. Erkundige dich über die folgenden Verfahren und erstelle eine kurze Zusammenfassung:
Referenzfehler: Es sind <ref>-Tags vorhanden, jedoch wurde kein <references />-Tag gefunden.